

科研创新成果
近日,新疆医科大学第一附属医院重症医学中心于湘友教授、重症医学三科主任马龙联合南京医科大学附属淮安第一医院吴昆博士团队,在国际权威医学期刊Nature子刊-生物学领域顶刊《Communications Biology》(中科院1区Top)上发表了一项最新研究成果,题为“STAT1 promotes ferroptosis and inflammation in mouse hepatic ischemia-reperfusion injury”,马龙为通讯作者。

研究团队

于湘友

马龙

吴昆
研究简介
这项研究聚焦于“肝脏缺血再灌注损伤”——这是肝切除、肝移植等手术中常见且危险的并发症。简单来说,就是当肝脏在手术中暂时缺血,恢复供血后反而可能引发更严重的损伤。虽然科学家们已经知道“铁死亡”(一种铁依赖性的细胞死亡方式)在其中扮演重要角色,但具体是哪些分子在背后“操控”这一过程,仍不明确。围绕这一关键科学问题,研究团队通过分析小鼠的肝组织样本,锁定了一个关键分子——STAT1。研究团队以信号转导与转录激活因子1(STAT1)为切入点,通过转录组、蛋白组、细胞模型和小鼠模型的多层验证,深入解析STAT1于肝脏缺血再灌注损伤中的病理作用。他们发现,在肝脏缺血再灌注损伤过程中,STAT1的含量明显上升,并且会“压制”另一个名为miR-497-5p的分子。这种压制导致去乙酰化酶HDAC7活跃起来,进而推动铁死亡的发生、加剧炎症反应,最终造成肝细胞损伤。
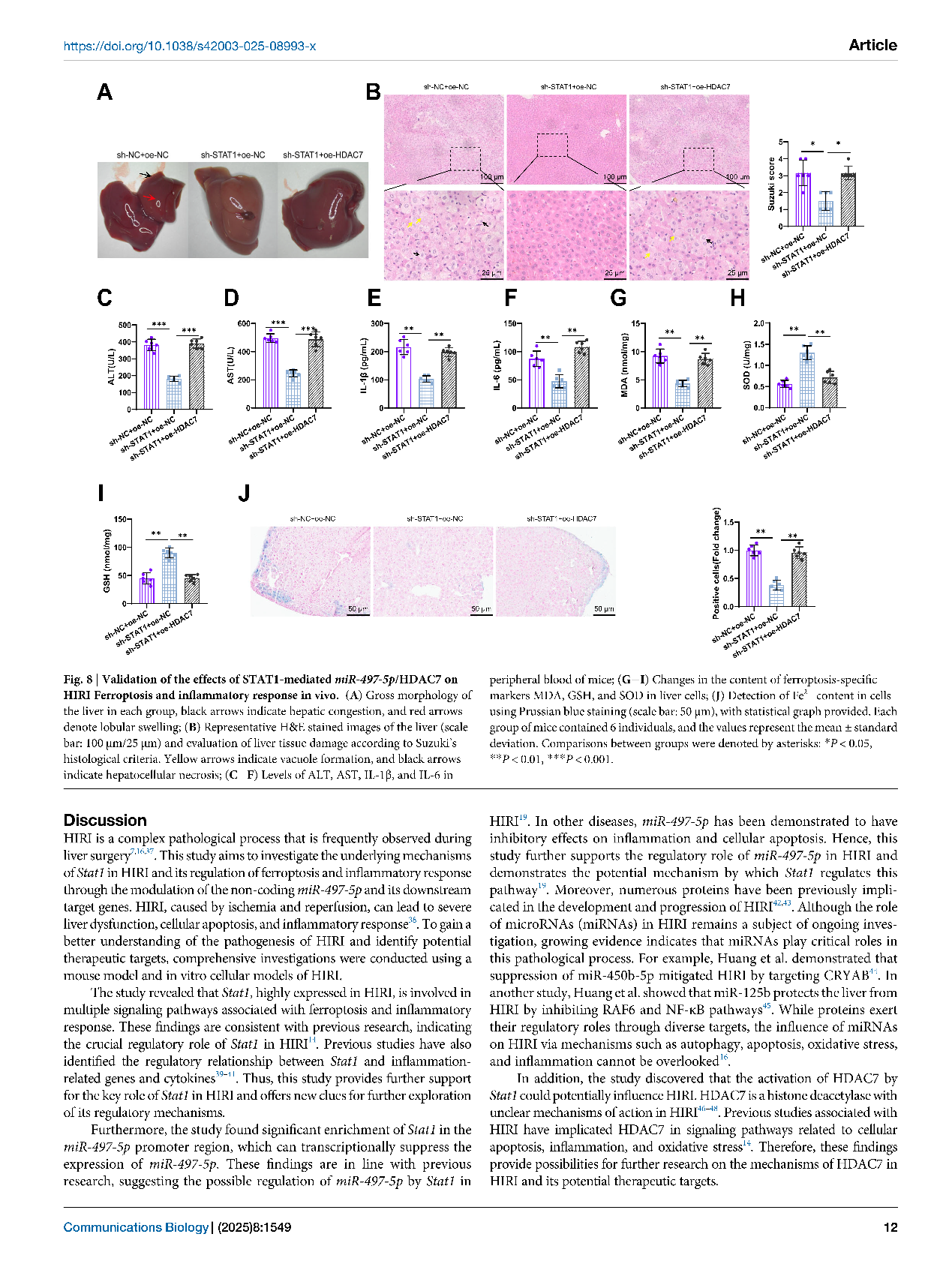
为了验证这一机制,研究人员进行了干预实验:当他们在小鼠模型中降低STAT1的表达,或提高miR-497-5p的水平时,肝损伤明显减轻;而如果人为增加HDAC7,保护效果就会消失。这说明,STAT1–miR-497-5p–HDAC7这条信号通路,确实是调控肝脏损伤的关键环节。
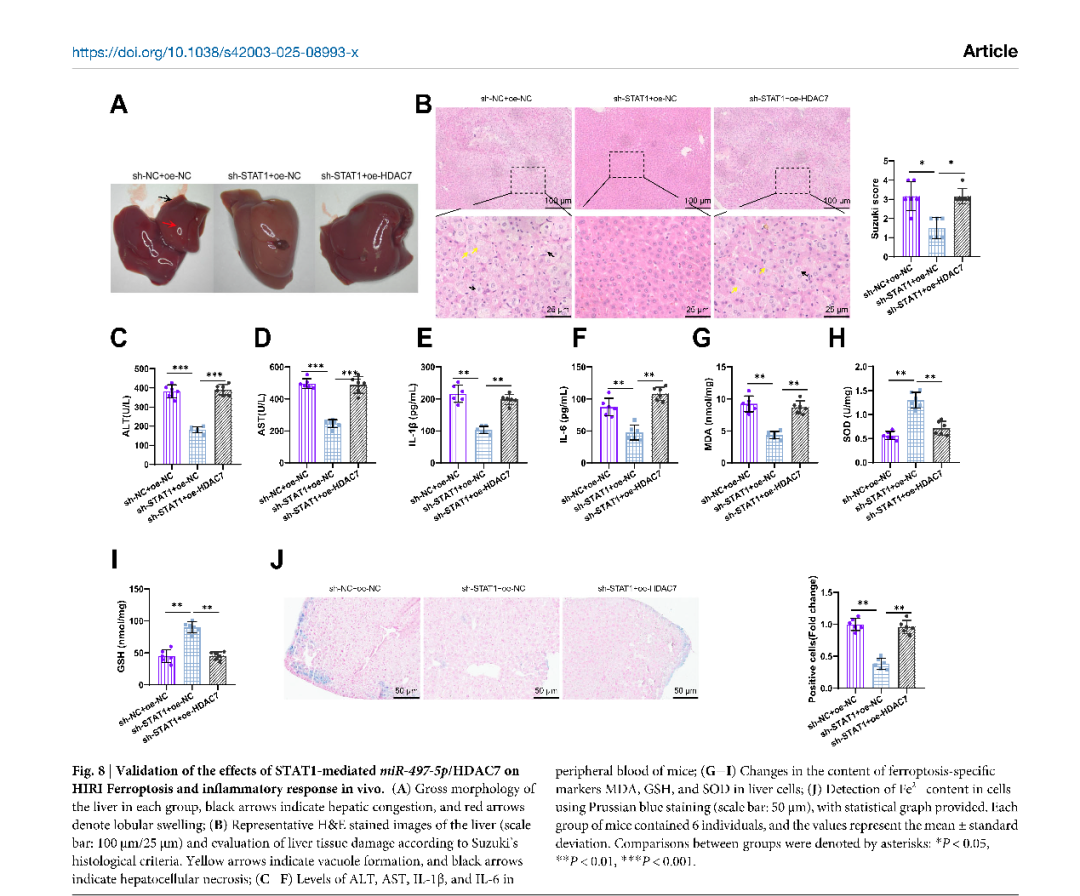
该研究系统揭示STAT1通过抑制miR-497-5p、激活HDAC7促进铁死亡与炎症级联,是调控肝脏缺血再灌注损伤的核心枢纽,不仅揭示了肝脏损伤背后的新机制,也为未来临床治疗提供了潜在的靶点。通过干预这一通路,未来或许能开发出保护肝脏、减轻手术并发症的新策略,对于肝移植、肝脏外科及重症监护等领域具有重要价值。

研究价值
本研究以多组学联合机制验证为基础,建立了从关键分子筛选、通路分析到体内干预验证的严密研究体系,较全面揭示了HIRI的上游调控机制,阐明了:(1)铁死亡调控枢纽:明确STAT1是连接炎症反应与铁死亡的关键节点,为解释HIRI中多通路耦合损伤提供了机制支撑。(2)揭示miR-497-5p/HDAC7的病理功能:阐明STAT1通过抑制miR-497-5p、解除对 HDAC7的抑制,从而驱动铁死亡与炎症放大,为非编码RNA和表观调控在HIRI中的作用提供新证据。(3)提供可干预的多层靶点:STAT1、miR-497-5p与HDAC7均显示可逆调控潜力,为未来药物开发、基因治疗以及围手术期策略优化奠定基础。研究团队以临床高发、高危的手术相关肝损伤为问题导向,通过关键因子筛选-机制验证-体内干预验证的闭环式框架,提供了面向临床可转化的重要基础研究成果。该研究展示了依托系统多组学和精准分子机制验证的原创性工作路线,在揭示HIRI关键致损通路方面形成了具有国际可比性的方法范式;不仅深化了对铁死亡在HIRI中作用的认识,也为肝脏保护策略提供了新的治疗思路,强调从多维度整合数据以寻找可靶向干预的关键节点,对于推动重症医学、肝脏外科学、移植医学及围手术期器官保护策略的发展具有重要价值。